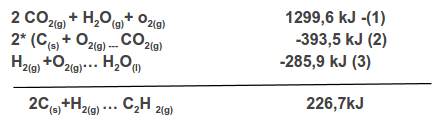Hess se ocupó totalmente a la química y uno de las obras más conocida fue la Ley de la suma constante de calor, que luego fue nombra como Ley de Hess en su honor; principalmente explicaba que la entalpía de una reacción se podía lograr sumando algebraicamente las entalpías de otras reacciones algunas vinculadas con la que importa. La Ley de Hess es el empleo de las reacciones químicas convirtiéndose en uno de los primeros principios de la termodinámica.
Este principio es un sistema cerrado adiabático, es decir, que no hay intercambio de calor con otros sistemas o su entorno como si está aislado, que se desarrolla en una fase inicial a otra fase final. Por ejemplo:
El calor de formación ðH1 del monóxido de carbono, CO:
C + 1/2 O2 = CO AH1
No puede establecerse directamente en el entorno en que se produce, parte del CO se convierte en CO2, pero si se puede medir directamente con el calorímetro, los calores de reacción de los próximos procesos:
AH2 = 282´6 kJ/mol
C + O2 = CO2
AH3 = -392´9 kJ/mol
El calor de reacción es la suma algebraica de los calores de estas reacciones.
El calor de reacción de un establecido proceso químico es constantemente el mismo, cualquiera que sea el proceso hecho por la reacción o sus fases intermedias.
La entalpía es una magnitud de la termodinámica representada con la letra H mayúscula y describe la cantidad de energía que un sistema intercambia con su entorno. En la ley de Hess explica que los cambios de entalpía son aditivos, ΔHneta = ΣΔHr y contiene tres normas:
- Si la ecuación química es invertida, el símbolo de ΔH se invierte también.
- Si los coeficientes son multiplicados, multiplicar ΔH por el mismo factor.
- Si los coeficientes son divididos, dividir ΔH por el mismo divisor.
Por ejemplo: Se calcula la entalpía de reacción para la reacción:
2 C(s) + H2(g) → C2H2(g)
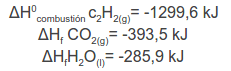
Los datos son los siguientes:
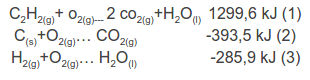
Se plantean las ecuaciones correspondientes a las entalpías dadas:
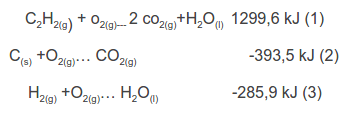
Se ubica en ellas a los reactantes y productos de la reacción química que se busca:
Ahora se deben ajustar las ecuaciones:
- La ecuación (1) se debe invertir (también se invierte el valor de la entalpía).
- La ecuación (2), se debe multiplicarla por 2 (se multiplica toda la ecuación, tanto reactantes como productos y el valor de la entalpía, ya que es propiedad extensiva.
- la ecuación (3), se deja igual.
La sumatoria de las ecuaciones ajustadas debe dar la ecuación problema.
- Se suman o se anulan los reactantes y productos.
- Las entalpías se suman algebraicamente.