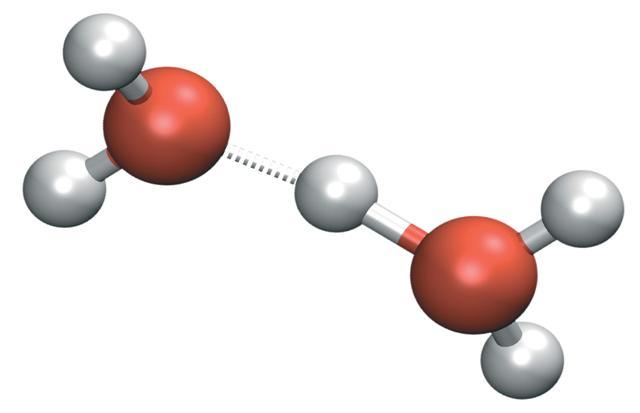
La ionización es la formación de moléculas o átomos con carga eléctrica. Los átomos son eléctricamente neutros ya que los electrones con carga negativa son iguales en número a los protones de carga positiva en los núcleos.
El número de protones de un átomo permanece igual durante los cambios químicos comunes (llamados reacciones químicas), pero se pueden perder o ganar electrones.
La pérdida de uno o más electrones a partir de un átomo neutro forma un catión, un ion con carga neta positiva. Por ejemplo, un átomo de sodio (Na) fácilmente puede perder un electrón para formar el catión sodio, que se representa como Na+.
Por otra parte, un anión es un ion cuya carga neta es negativa debido a un incremento en el número de electrones. Por ejemplo, un átomo de cloro (Cl) puede ganar un electrón para formar el ion cloruro Cl-
Al combinarse sodio con cloro, para formar cloruro de sodio (sal común de mesa), cada átomo de sodio cede un electrón a un átomo de cloro. En un cristal de cloruro de sodio la fuerte atracción electrostática entre iones de cargas opuestas mantiene firmemente los iones en su sitio, estableciéndose un enlace iónico. Se dice entonces que el cloruro de sodio, es un compuesto iónico porque está formado por cationes y aniones.
Un átomo puede perder o ganar más de un electrón, como el ion férrico con tres cargas positivas (Fe+3) e ion sulfuro con dos cargas negativas (S=). Estos iones, lo mismo que los iones sodio y cloruro, reciben el nombre de iones monoatómicos porque contienen solamente un átomo. Salvo algunas excepciones los metales tienden a formar cationes y los no metales, aniones.
Además, es posible combinar dos o más átomos y formar un ion que tenga una carga neta positiva o negativa. Los iones que contienen más de un átomo, como en el caso de OH- (ion hidróxido), CN- (ion cianuro) y NH4+ (ion amonio) se llaman iones poliatómicos.
La energía mínima que se requiere para separar un electrón de un átomo aislado (o un ion) en su estado basal se conoce como energía de ionización, y se representa en kJ/mol. La magnitud de esta energía es una medida de que tan “fuertemente” se encuentra unido el electrón al átomo. Cuanto mayor es la energía de ionización es más difícil quitar el electrón del átomo.