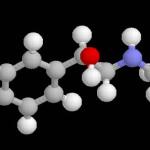
Qué es molécula
Es la unión o conjunto de dos o más átomos, los cuales pueden ser iguales o diferentes, si se llegan a separar estos átomos cambiaría las propiedades de la materia. Esta es considerada la porción más pequeña que se puede obtener de la materia para que pueda conservar sus propiedades químicas.
La principal razón por las que se forman las moléculas, es que hay átomos que tienden a alcanzar una condición mínima de energía y para lograrlo lo hace a través de los enlaces covalentes con otros átomos que presenten la misma condición, este enlace no puede disolverse con facilidad y es allí cuando nacen.
En una sustancia, las moléculas que las componen no se encuentran estáticas, por el contrario, se encuentran en constante movimiento, el cual es denominado vibración molecular, y esta a su vez puede ser de flexión o tensión.
El término es un diminutivo del vocablo latín “moles” que significa masa, así que el término significa “masa pequeña”.
Características de las moléculas
- Las moléculas son uniones entre dos átomos, aunque también puede ser uniones entre más de dos, esto hace que poseen partes bastantes diferentes a excepción del núcleo de los átomos, el cual se compone por un número de neutrones y protones que dependen del elemento, además, poseen una nube de electrones orbitándolos.
- La existencia de macromoléculas de tipo orgánicas brindan la capacidad de dividir sus cadenas en un grupo de moléculas simples, mismas que tienen un número estático de átomos distribuidos en una misma forma.
- Las moléculas pueden tener múltiples propiedades, aunque eso siempre va a depender de la conformación de átomos que posean.
- Una de esas propiedades es la polaridad, la cual hace referencia a la presencia de cargas con un desnivel electromagnético de átomos, lo cual hace que la molécula posea componentes eléctricos específicos, estos son rechazar o atraer al resto de moléculas.
- Un conjunto de átomos es capaz de reaccionar de acuerdo a los componentes que los conforman, entonces, formarán parte de un “todo” estructurado con mayor medición, aunque también podrá tener la capacidad de intercambiar sus componentes con otro conjunto de átomos.
- Su equilibrio estará sujeto a los distintos niveles de energía presentes en ella.
- Son elementos fundamentales de cualquier sustancia.
- Una molécula aunque se encuentre dividida siempre conservará cada una de sus propiedades tanto químicas como físicas.
Tipos de moléculas
Este conjunto de átomos se clasifica en una serie de tipos, estas son las moléculas discretas, macromoléculas y biomoléculas.
Moléculas discretas
Son aquellas que poseen números de átomos específicos y no existe importancia entre sí poseen los mismos elementos o algunos diferentes, simplemente se clasifican de acuerdo a la cantidad de átomos que se encuentran en su estructura. Entendiendo eso, se encuentran las moléculas monoatómicas, diatómicas, triatómicas y tetralogías.

Macromoléculas
Se trata de aquellas cadenas moleculares con un tamaño relativamente mayir al resto, compuestas por un conjunto de átomos altamente simples y repetidos, las cuales se unen entre sí para conseguir secuencias complejas y extensas, aunado a eso, también poseen propiedades específicas y nuevas.
Esta vertiente es importante porque forma parte del desarrollo químico de la vida. Además, tiene su propia clasificación de acuerdo a la inestabilidad o estabilidad electromagnética.
La primera es el conjunto de átomos polares, quienes se encuentran dotados de grados de carga eléctrica, esto hace que extienda una desigualdad de atracción en la nube de electrones que se encuentran alrededor de los núcleos de átomos enlazados. Acá, los electrones poseen la capacidad de orbitar a los núcleos con cargas mayores, de manera que el conjunto se cargue eléctricamente como una batería, esto quiere decir que abarca sus polos positivos y negativos.
La segunda clasificación comprende a los conjuntos de átomos apolares, es decir, aquellas partículas con electronegatividad igual o similar, carente de desigualdades frente a la atracción de electrones debido a los núcleos atómicos, es por ello que conservan su carga totalmente neutra y sin polos.
Biomoléculas
Se trata de partículas que vienen de los seres vivos, mismos que se componen por seis elementos químicos conocidos como bioelementos, estos son el carbono (C), oxígeno (O), (H) fósforo (P), nitrógeno (N) y azufre (S). Cada uno de estos son constituyentes de biomoléculas, es decir, a los glúcidos, aminoácidos, lípidos, proteínas, ácidos nucleicos y vitaminas.
Su importancia radica en que logran la formación de enlaces covalentes entre sí, de manera que puedan compartir electrones gracias a su diferencia menor en electronegatividad.
También permiten la posibilidad de formar esqueletos tridimensionales a los átomos de carbono, de manera que puedan formar o generar compuestos con números variables de carbonos. Acá se puede evidenciar que se trata de moléculas orgánicas.
Por otro lado, tienen la capacidad de lograr la creación de múltiples enlaces de moléculas orgánicas, es decir, enlaces dobles o triples entre carbono y carbono, carbono y oxígeno y carbono y nitrógeno.
Por último, logran la posibilidad que los elementos tengan variedad entre los grupos funcionales, es decir, los aldehídos, alcoholes, cetonas, aminas, ácidos, etc. Con propiedades físicas y químicas totalmente diferentes.
Biología molecular
Se trata de una rama de la biología cuyo objetivo es estudiar y analizar los procesos en los que se desarrollan los seres vivos, todo desde un punto de vista o un ángulo molecular.
En términos generales, esta vertiente explica cada fenómeno que ocurre en la vida de acuerdo a las propiedades macromoleculares de los seres vivos. Acá se estudian dos macromoléculas en específico, la primera son los ácidos nucleicos, entre ellos, el ADN que compone los genes, pero también está la proteína, la cual funciona como un agente activo en los seres vivos.
Ejemplos de moléculas
Dentro de los ejemplos más básicos de las moléculas, están las siguientes.
- H2: hidrógeno.
- HCI: ácido clorhídrico.
- CO2: dióxido de carbono.
- H2SO4: ácido sulfúrico.
- C2H5OH: etanol.
- NaCI: cloruro de sodio.
- H3PO4: ácido fosfórico.
- CHCI3: cloroformo.
- C6H12O6: molécula de glucosa.
- C12H22O11: sacarosa.
- C3H6O: acetona.
- C6H10O5: celulosa.
- AgNO3: nitrato de plata.
- NH3: amoníaco.