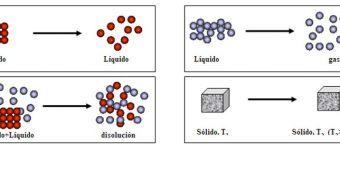
Qué es la termodinámica
La definición de la termodinámica señala que es la ciencia que se ocupa concretamente de las leyes que rigen la transformación de energía térmica en energía mecánica y viceversa. Se basa en tres principios fundamentales y tiene evidentes implicaciones filosóficas y además, permiten la formulación de conceptos que figuran entre los de mayor alcance en la física.
Dentro de esta se emplean distintos métodos de investigación y apreciación de los objetos requeridos, como lo pueden ser las magnitudes extensivas y no extensivas. La extensiva estudia la energía interna, la composición molar o el volumen y la segunda, por su parte estudia la presión, temperatura y potencial químico; aun así, se utilizan otras magnitudes para el análisis veraz.
El vocablo se deriva de las palabras griegas θερμο y δύναμις, que significan “termo” y “calor.
Qué estudia la termodinámica
De una manera particular se encarga del estudio de los fenómenos en los que existe transformación de energía mecánica en térmica o viceversa, fenómenos que reciben el nombre de transformaciones termodinámicas.
Qué es un sistema termodinámico
Se llama sistema termodinámico al cuerpo, o conjunto de cuerpos, sobre el que tiene lugar una transformación termodinámica.
Un sistema termodinámico es una región del espacio que está enfocada al análisis de un problema. La región fuera del sistema que interactúa con él, se denomina entorno del sistema.
El sistema termodinámico interactúa con su entorno a través del intercambio de materia y energía.
La superficie que separa el sistema del resto de su contexto recibe el nombre de pared, y de acuerdo a sus característica se clasifican en tres tipos que son:
Sistema termodinámico abierto
Es el intercambio entre la energía y la materia.
Sistema termodinámico cerrado
No realiza intercambio de materia, pero si intercambia energía.
Sistema termodinámico aislado
No intercambia materia ni energía.
Principios de la termodinámica
La termodinámica cuenta con ciertos fundamentos que determinan las cantidades físicas básicas que representan a los sistemas termodinámicos. Dichos principios explican cómo es su conducta bajo ciertas condiciones e impiden el surgimiento de ciertos fenómenos.
Se dice que un cuerpo está en equilibrio térmico cuando el calor que percibe y emite son iguales. En este caso la temperatura de todos sus puntos es y se mantiene constante.
Un caso paradójico de equilibrio térmico es un hierro expuesto al sol. La temperatura de éste cuerpo, una vez alcanzado el equilibrio se mantiene superior a la del ambiente debido a que el aporte continuo de energía solar se compensa con la que el cuerpo irradia y la pierde con su conducción y convección.
El principio cero de la termodinámica o la ley cero de la termodinámica está presente cuando dos cuerpos en contacto están en la misma temperatura una vez alcanzado el equilibrio térmico. Se comprende con facilidad que el cuerpo más frío se caliente y el más caliente se enfría, y así va disminuyendo el flujo neto de calor entre ellos a medida que se reduce su diferencia de temperatura.
Primer principio de la termodinámica
El primer principio de la termodinámica es el principio de la conservación de la energía (propiamente y de acuerdo con la teoría de la relatividad de la materia-energía) según la cual ésta no se crea ni se destruye, aunque sí puede transformarse de una forma a otra.
Segundo principio de la termodinámica
Este segundo principio trata acerca de la irreversibilidad de los eventos físicos, sobre todo, al momento de efectuar una transferencia de calor.
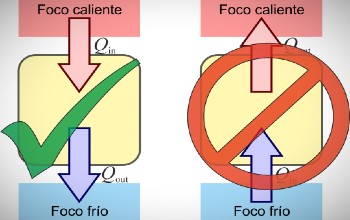
Este principio establece que es poco probable que un sistema termodinámico lleve a cabo un proceso que atraiga todo el calor presente en una fuente caliente y lo transforme totalmente en energía mecánica, sin arrojar calor al entorno y mantener el mismo estado inicial.
Una gran cantidad de hechos experimentales, demuestran que las transformaciones que se producen de forma natural tienen un sentido determinado, sin que se observe jamás, que espontáneamente se realice en un sentido opuesto.
El primer principio de la termodinámica nos permite asegurar que en los cambios de una forma de energía a otra no ha habido ni incremento ni disminución de la potencia inicial, el segundo principio nos dice que parte de esa energía se habrá disparado en forma de calor.
Tercer principio de la termodinámica
La tercera ley fue desarrollada por el químico Walther Nernst durante los años 1906-1912, por lo que a menudo se le conoce como el teorema de Nernst o el postulado de Nernst. Este tercer principio de la termodinámica dice que la entropía de un sistema de cero absoluto es una constante definida. Esto es debido a que hay un sistema de temperatura cero en su estado fundamental, por lo que su entropía la determina la degeneración del estado fundamental.
En 1912, Nernst estableció la ley así: «Es imposible por cualquier procedimiento alcanzar la isoterma T = 0 en un número finito de pasos»
Procesos termodinámicos
En el concepto de la termodinámica, los procesos son los cambios que se producen en un sistema y que lo llevan de un estado de equilibrio inicial a un estado de equilibrio final. Éstos se clasifican de acuerdo a la variable que se ha mantenido de manera constantes a lo largo del proceso.
Un proceso se puede presentar desde el derretimiento del hielo, hasta la ignición de una mezcla de aire-gasolina para realizar el movimiento de los pistones de un motor de combustión interna.
Hay tres condiciones que pueden variar en un sistema termodinámico: temperatura, volumen y presión. Los procesos termodinámicos se estudian en gases, ya que los líquidos son incompresibles y no se producen cambios de volumen. Además, debido a las altas temperaturas, los líquidos se convierten en gases. En sólidos, los estudios termodinámicos no se llevan a cabo porque son incompresibles y no hay trabajo mecánico en ellos.
Tipos de procesos termodinámicos

Estos procesos se clasifican de acuerdo a su enfoque, a mantener una de las variables constantes, bien sea la temperatura, la presión o el volumen. Además se aplican otros criterios como es el intercambio de la energía y la modificación de todas sus variables.
Proceso isotérmico
Los procesos isotérmicos son todos aquellos en los que la temperatura del sistema permanece constante. Esto se hace trabajando, de modo que las otras variables (P y V) cambian con el tiempo.
Proceso isobáricos
El proceso isobárico es uno en el que la presión permanece constante. La variación de la temperatura y el volumen definirá su desarrollo. El volumen puede cambiar libremente cuando se modifica la temperatura.
Procesos isocóricos
En procesos isocóricos el volumen permanece constante. También se puede considerar como aquellos en los que el sistema no genera ningún trabajo (W = 0).
Básicamente, son fenómenos físicos o químicos que se estudian dentro de cualquier recipiente, ya sea con agitación o no.
Proceso adiabático
El proceso adiabático es ese proceso termodinámico en el que no hay intercambio de calor desde el sistema hacia el exterior o en la dirección opuesta. Ejemplos de este tipo de proceso son los que se pueden realizar en un termo para bebidas.
Ejemplos de procesos termodinámicos
- Un ejemplo del proceso isocórico: El volumen del gas se mantiene de una manera constante. Al ocurrir cualquier tipo de cambio de temperatura vendrá acompañado de un cambio de presión. Como es el caso del vapor en una olla a presión, ésta aumenta su presión a medida que se calienta.
- Como ejemplo del proceso Isotermo: La temperatura del gas se mantiene constante. A medida que el volumen aumenta la presión disminuye. Por ejemplo, un globo en una máquina de hacer vacío, va aumentando su volumen a medida que se va haciendo el vacío.
- En relación al proceso adiabático: por ejemplo, la compresión del pistón en una bomba de inflado de ruedas de bicicleta, o la descompresión rápida del émbolo de una jeringa, realizando previamente comprimido con el agujero de salida taponada.